| Laufzeit: |
01.10.2022 - 31.12.2025 |
|---|---|
| Partner: |
Karlsruher Institut für Technologie (KIT) Institut für Mikroverfahrenstechnik
Technische Hochschule Mittelhessen (THM) Institut für Bioverfahrenstechnik und Pharmazeutische Technologie |
| Geldgeber: |
IGF (BMWK) Förderkennzeichen: 01IF22612 N/1 |
| Bearbeiter: | Aneta Pashkova |
| Abteilung: | Chemische Technik |
Motivation
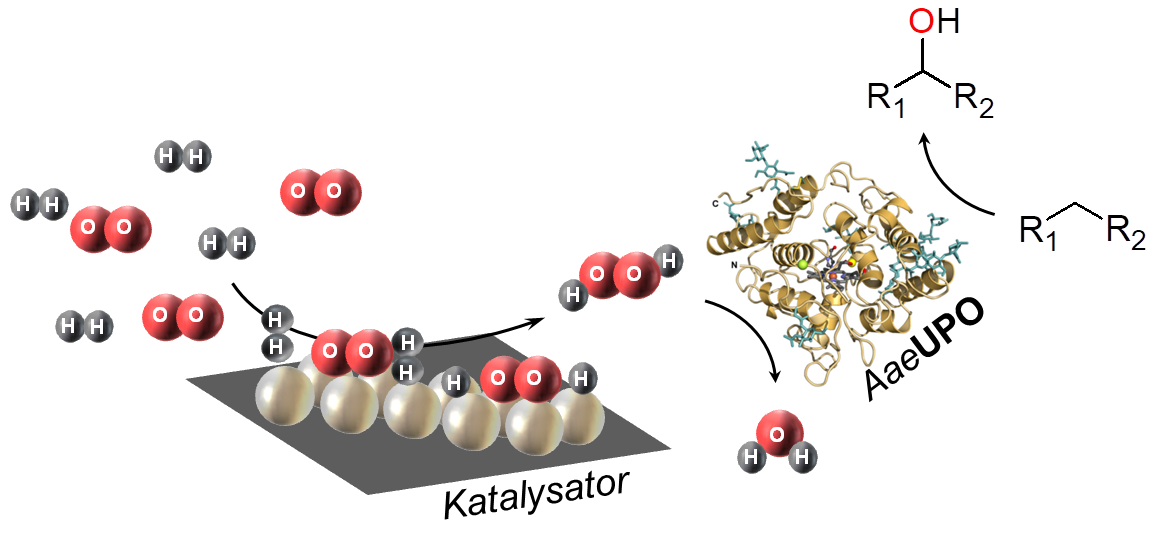
Der Einsatz von Enzymen gewinnt in der chemischen Synthese zunehmend an Bedeutung. Biologische Katalysatoren ermöglichen außerordentlich selektive Prozessschritte unter milden Bedingungen, und können die Prozesse somit durch kürzere und effizientere Syntheserouten mit weniger Nebenprodukten nachhaltiger machen. Neben bereits vielfältig in der Industrie eingesetzten hydrolytischen Enzymen (EC 3) weisen vor allem Oxidoreduktasen (EC 1) ein gewaltiges Potential für die Anwendung in der synthetischen organischen Chemie auf. Einen Spezialfall in dieser Enzymklasse stellen Peroxygenasen dar, welche im Gegensatz zu vielen anderen Oxidoreduktasen keine kostspieligen Cofaktoren benötigen, sondern das kostengünstige und vergleichsweise einfach herzustellende Wasserstoffperoxid (H2O2) verwenden können. Weiterhin sind Peroxygenasen besonders interessant, weil sie ein breites Spektrum an relevante Synthesereaktionen ermöglichen. Z.B. katalysiert die unspezifische Peroxygenase aus Agrocybe aegerita (AaeUPO) Reaktionen wie die Hydroxylierung oder Halogenierung von C-H-Bindungen, die Epoxidierung von C=C-Doppelbindungen, diverse Heteroatom Oxidationen, Etherspaltungen, N-Dealkylierungen sowie einige Ein-Elektronen-Oxidationen. Hierbei akzeptiert das Enzym auch jeweils eine Vielzahl an unterschiedlichsten Substraten.
Ein sehr großes Hindernis beim Einsatz von Peroxygenasen in der synthetischen Chemie ist bislang jedoch die geringe Stabilität der Enzyme gegenüber ihrem Cosubstrat, Wasserstoffperoxid. Einerseits wird Wasserstoffperoxid in stöchiometrischen Mengen für die Reaktion verbraucht, jedoch führt es bei zu hohen Konzentrationen zu einer extrem schnellen Inaktivierung des Enzyms. Aufgrund der hohen Kosten der Enzyme muss für einen wirtschaftlichen Betrieb eines entsprechenden Syntheseprozesses die katalytische Produktivität der Enzyme deutlich gesteigert werden. Um gleichzeitig einen hohen Umsatz bei der Reaktion zu erreichen und der Inaktivierung des Enzyms entgegen zu wirken, muss die H2O2-Konzentration auf einem konstant niedrigen, aber für die Reaktion ausreichenden Niveau gehalten werden. Die verbrauchte Menge an Wasserstoffperoxid muss somit entweder kontinuierlich nach-dosiert oder in-situ bereitgestellt werden.
Bei einer Zudosierung von H2O2 oder äquivalenten organischen Hydroperoxiden sind trotz präziser online Analytik und ausgeklügelten Dosiersystemen lokale hot spots sowie eine unerwünschte Volumenerhöhung nicht zu vermeiden. Die deutlich einfachere und elegantere Lösung ist daher die in-situ-Bereitstellung. Die bis jetzt erforschten Wege der in-situ Bereitstellung von H2O2 für die Enzymkatalyse sind: enzymatisch, elektrochemisch oder photokatalytisch, jeweils mit unterschiedlichen Vor- und Nachteilen. Diese Methoden erhöhen die Komplexität der Reaktion und/oder benötigen zur Ausführung spezifische Ausrüstung und Expertise.
Eine vielversprechende, jedoch noch nicht intensiv erforschte Alternative für die in-situ H2O2-Bereitstellung ist die chemisch katalysierte Wasserstoffperoxid-Direktsynthese (H2O2-DS) aus den Elementen (H2 und O2) an heterogenen Katalysatoren. Im Gegensatz zu den oben genannten Alternativen wird für diesen Ansatz nur eine Gasversorgung (H2/O2) sowie ggf. ein Druckreaktor benötigt, welche beide in der Regel in chemischen Laboren und Produktionsanlagen bereits vorhanden sind.
Ziele und geplante Arbeiten
Die Kopplung der chemisch katalysierten H2O2-DS an die Enzymkatalyse soll in diesem Projekt detailliert untersucht und kritisch evaluiert werden. Hierbei sollen geträgerte Edelmetall-Katalysatoren in Verbindung mit der unspezifischen Peroxygenase aus Agrocybe aegerita (AaeUPO) für die enantioselektive Hydroxylierung von Ethylbenzol eingesetzt werden. Da diese Modellreaktion mit den alternativen H2O2-Erzeugungsmethoden bereits gut beschrieben ist ermöglicht dies eine Bewertung des Systems. Aufbauend auf den gewonnenen Erkenntnissen soll ein generisches technisches System entworfen werden und bezüglich kontinuierlicher Reaktionsführung und maximaler Prozessleistungsfähigkeit optimiert werden. Zudem soll das System auch für weitere Reaktionen validiert werden.
Um die Kopplung der H2O2-DS und Enzymkatalyse technisch nutzbar zu machen haben sich drei Partner aus komplementären Bereichen zusammengefunden welche die katalytischen, enzymtechnischen und verfahrenstechnischen Aspekte der Chemo- Bio-Katalyse ideal adressieren. Dabei sind u.a. folgende Arbeiten geplant:
DFI: detaillierte Untersuchung der Enzymstabilitäten unter H2O2-DS-Bedingungen und der H2O2-DS-Kinetik unter enzymatischen Reaktionsbedingungen; Systemintegration zur Entwicklung eines gekoppelten kontinuierlichen Verfahrens für die Synthese spezieller Chemikalien wie z.B. chirale pharmazeutische Wirkstoffe.
KIT: Prozesssimulation anhand gemessener Reaktionskinetiken und Konzeptentwicklung zur Tandem-Katalyse; Design und Konstruktion von Mikroreaktoren sowie Integration der Heterogen-Katalysatoren auf geeigneten Träger bzw. Mikroreaktoren durch Druckverfahren
THM: Entwicklung von Enzymimmobilisierungsverfahren und Optimierung der Enzymproduktivität und Stabilität in organischen Lösungsmitteln durch molekularbiologische Optimierung
zurück

Das IGF-Vorhaben wird durch das Bundesministerium für Wirtschaft und Klimaschutz aufgrund eines Beschlusses des Deutschen Bundestages gefördert.
Dr. Jonathan Bloh
Tel.: 069 / 75 64-387
E-Mail: jonathan.bloh
Dr. Aneta Pashkova
Tel.: 069 / 75 64-404
E-Mail: aneta.pashkova